http://www.ki2100.com
هندسه دوجيني و ساختار اتم
ابتدا بايد بدانيم كه مفهوم عبارات ( اصطلاحات ) زير در فيزيك چيست ؟
1- طيف اتمي :
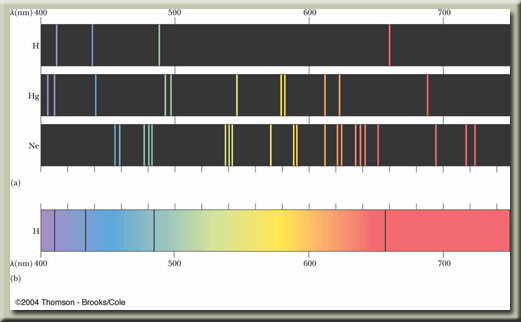
همانطور كه ميدانيم نيوتن با گذراندن نور خورشيد از منشور ، طيف نور سفيد را تجزيه كرد . نيوتن نشان داد كه نور سفيد آميزهاي از رنگهاي مختلف است . گسترهي طول موج اين رنگها از 0.4 ميكرون ( بنفش مريي ) تا 0.7 ميكرون ( قرمز مريي ) ميباشد . طيف نور سفيد يك طيف پيوسته است . به همين ترتيب ميتوان طيف هر نوري را توسط پاشندگي در منشور شناسايي كرد . طيف نور گسيل شده از بخار هر عنصري را طيف اتمي آن عنصر مينامند . طيف اتمي عناصر مختلف با هم تفاوت دارد . اما علت اينكه در طيف اتمي خطوط مختلفي ديده ميشود چيست ؟

تصوير فوق تجزيه نور سفيد را نشان ميدهد
2- خطوط طيفي :
طيف اتمي ، مستقيما به ترازهاي انرژي اتم نسبت داده ميشود . هر خط طيفي متناظر يك گذار خاص بين دو تراز انرژي يك اتم است . پس آنچه در طيف نمايي داراي اهميت است ، تعيين ترازهاي انرژي يك اتم به كمك اندازه گيري طول موجهاي طيف خطي گسيل شده از اتمها است . پايينترين تراز انرژي ، حالت پايه است و همه ترازهاي بالاتر ، حالتهاي برانگيخته ناميده ميشوند . طبق تعاريف فعلي موقعي كه يك اتم از حالت برانگيخته بالاتر به يك حالت برانگيخته پايينتر گذر كند ، موج الكترومغناطيس ( يك طيف نور حامل انرژي ) متناظر به يك خط طيفي گسيل ميشود . البته بعدا توضيح خواهيم داد كه برعكس اين قضيه نيز صادق است يعني با جذب انرژي توسط ترازهاي انرژي ، اتم به يك حالت برانگيختهي بالاتر صعود و با دفع انرژي به يك حالت پايينتر انرژي نزول ( گذر ) ميكند .

تصوير فوق طيف نشري خطي عنصر آهن را نشان ميدهد
3 - طيف نشري
اگر جسمي نور توليد كند و نور توليد شده را از منشوري عبور دهيم ، طيفي به دست ميآيد كه طيف نشري ناميده ميشود . اگر رنگهاي طيف حاصل به هم متصل باشند ، طيف نشري اتصالي و اگر بين آنها فاصلهاي باشد ، طيف نشري را انفصالي يا خطي مينامند . به عنوان مثال لامپ حاوي بخار يا گاز بسيار رقيق را در نظر بگيريد . اين لامپ به صورت لوله باريك شيشهاي است كه درون آن يك گاز رقيق در فشار كم وجود دارد . دو الكترود به نامهاي كاتد و آند در دو انتهاي لوله قرار دارند . اگر بين اين دو الكترود ، ولتاژ بالايي برقرار شود ، اتمهاي گاز درون لامپ شروع به گسيل نور ميكنند . اگر اين گاز مربوط به هليم باشد ، به رنگ زرد مايل به سبز روشن است كه اگر آن را از منشور بگذرانيم ، ميبينيم كه اين طيف پيوسته نيست . بلكه تنها از چند خط رنگي جدا از هم با طول موجهاي معين تشكيل شده است . يعني تصوير زير :

4- طيف جذبي
در سال 1814 فرانهوفر كشف كرد كه اگر به دقت طيف خورشيد را برسي كنيم ، خطهاي تاريكي در طيف پيوستهي آن مشاهده خواهيم كرد . اين مطلب نشان ميدهد كه بعضي از طول موجها در نوري كه از خورشيد به زمين ميرسد ، وجود ندارد و به جاي آنها ، در طيف پيوسته نور خورشيد خطهاي تاريك ( سياه ) ديده ميشود . اكنون ميدانيم كه گازهاي عناصر موجود در جو خورشيد ، بعضي از طول موجهاي گسيل شده از خورشيد را جذب ميكنند و نبود آنها در طيف پيوستهي خورشيد به صورت خطهاي تاريك ظاهر ميشود . در اواسط قرن نوزدهم معلوم شد كه اگر نور سفيد از داخل بخار عنصري عبور كند و سپس طيف آن تشكيل شود ، در طيف حاصل خطوط تاريكي ظاهر ميشود . اين خطوط توسط اتمهاي بخار جذب شدهاند .
در واقع هم در طيف گسيلي و هم در طيف جذبي هر عنصر ، طول موجهاي معيني وجود دارد كه از ويژگيهاي مشخصه آن عنصر است . طيفهاي گسيلي و جذبي هيچ دو عنصري مثل هم نيست . اتم هر عنصر دقيقا همان طول موجهايي را جذب ميكند كه اگر دماي آن به اندازه كافي بالا رود و يا بههر صورت ديگر برانگيخته شود ، آنها را تابش ميكند .
اين طيفهاي جذبي و نشري همگي مربوط به ترازهاي انرژي و يا بهتر است بگوييم به لايهها و زير لايههاي اتم عناصر مربوط ميشود زيرا در هندسه فضايي همانگونه كه براي مشخص كردن مكان يك شي در فضاي سه بعدي به سه پارامتر طول ، عرض و ارتفاع ( x y z ) نياز داريم ، براي مشخص كردن هريك از اوربيتالهاي يك اتم نيز به اين چنين پارامترهايي نياز داريم . به اين منظور از سه عدد m1 , l , n استفاده شده است كه اينها به اعداد كوانتومي مشهورند .
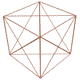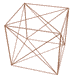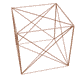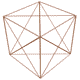
n عدد كوانتومي اصلي ناميده ميشود ، در مدل كوانتومي به جاي ترازهاي انرژي از واژهي لايههاي الكتروني استفاده ميشود و n سطح انرژي آنها را معين ميكند . n=1 پايدارترين لايهي الكتروني را نشان ميدهد و هر چه مقدار n بالاتر رود سطح انرژي لايهي الكتروني افزايش مييابد ( يعني براي بالا بردن الكترونها در لايهها ، مرحله به مرحله به انرژي بيشتري نياز داريم ) . اطراف هستهي اتم حداكثر هفت لايه الكتروني شناخته و شناسايي شده است كه همگي منطبق با تناسبات موجود در مدارها و ميان مدارهاي رسم شده در شكل توسعه يافته ستاره داوود ميباشند .
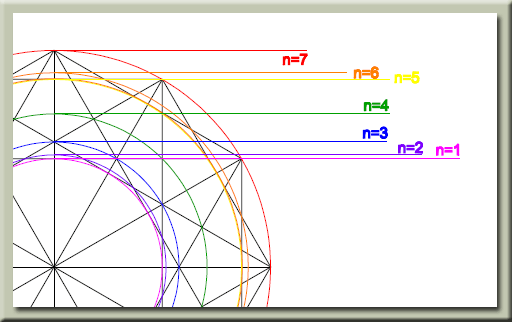
http://www.ki2100.com/dwf/mat/atom/1.dwf
http://www.ki2100.com/pdf/mat/atom/1.pdf
البته ما بايد اين موضوع را همواره در نظر بگيريم كه الكترونها در لايهها و زير لايهها ( داخل اتم ) نسبت به يكديگر جاذبه و دافعه داشته و ميتواند وضعيت آنها كمي متفاوت با شكل ترسيمي فوق باشد . ولي به هر حال ساختار كلي و پايهاي در اتمها ، همين تناسبات موجود در رسم ستاره داوود توسعه يافته است .
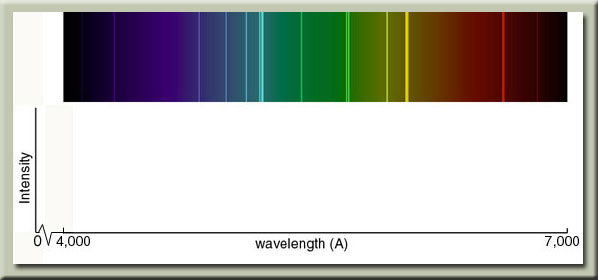
شكل فوق طيف نشري خطي عنصر كربن را نشان ميدهد
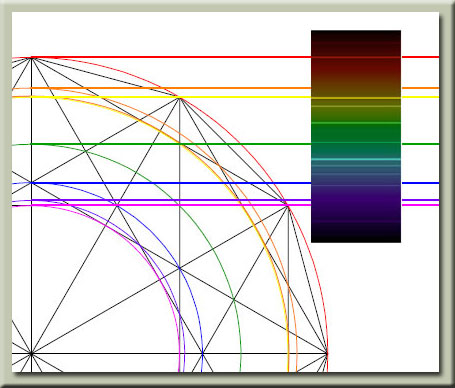
با مقايسهي طيف نشري خطي كربن با مدارها و ميان مدارهاي شكل توسعه يافته ستاره داوود ، متوجه تشابه تناسبات موجود ميشويم كه اين موضوع دال بر اين واقعيت است كه اتمها در ساختار فيزيكي خود از شكل توسعه يافته ستاره داوود و تناسبات موجود در آن تبعيت ميكنند . دليل اين موضوع چيست و چه ميتواند باشد ؟ در مطالب بعدي در اين رابطه توضيح خواهيم داد !

محمدرضا طباطبايي 15/8/86
http://www.ki2100.com
ساير مطالب ارايه شده :
سيستمهاي شمارش اعداد : ( مبناي دوجيني ، دستگاه شمارش واقعي اعداد در هستي ميباشد )
مكعب يك بستهي كامل از اعداد در مبناي دوازدهتايي يا سيستم شمارش دوجيني است
ستارهي داوود ، اختصار نماي ايزومتريك يك مكعب است
توسعهي رسم هندسي ستارهي داوود در صفحه و فضا ( خوشهي آفرينش )
8 دايره و 8 كره ، 7 ميان دايره و 7 ميان كره در شكل توسعه يافتهي ستاره داوود ( هفت آسمانها )
تركيب تناسب طلايی يا توالی فيبوناچي در ستارهي داوود توسعه يافته
ساعت ؛ تقويم و ستاره داوود توسعه يافته