چرا آب تَر هست؟!
چرا آب تَر هست؟!
سلام
این سوالو دبیر شیمیمون اول سال برسید و هنوز هم خودشون جوابشو ندادن
شاید مسخره به نظر بیاد اما من مقصر نیستم
ممنون می شم جواب بدید
این سوالو دبیر شیمیمون اول سال برسید و هنوز هم خودشون جوابشو ندادن
شاید مسخره به نظر بیاد اما من مقصر نیستم
ممنون می شم جواب بدید
نه ..... این برف را دیگر سر بازایستادن نیست
برفی که بر ابرو و بر موی ما می نشیند.....
برفی که بر ابرو و بر موی ما می نشیند.....
Re: چرا آب تره؟؟؟!!!!
شاید چون مایع هستش !
با سپاس
امگا
با سپاس
امگا
ذهن مانند چتر است . . وقتی عمل می کند که باز شده باشد !
Re: چرا آب تره؟؟؟!!!!
ممنون امگا عزیز اما همه مایع ها تر نیستنT3time نوشته شده:شاید چون مایع هستش !
با سپاس
امگا
نه ..... این برف را دیگر سر بازایستادن نیست
برفی که بر ابرو و بر موی ما می نشیند.....
برفی که بر ابرو و بر موی ما می نشیند.....
- javad123javad
نام: Javad
محل اقامت: NoWhere
عضویت : پنجشنبه ۱۳۸۷/۳/۲ - ۱۱:۱۷
پست: 912-
سپاس: 211
- جنسیت:
Re: چرا آب تره؟؟؟!!!!
سلام
به این خاطره که نیروی چسبندگی بین ملکول های آب از نیروی چسبندگی با اون سطحی که آب قرار داره کمتره.....به همین خاطر ملکول های آب از هم جدا شده و به سطح می چسبن که همون تر شدن هست...ولی برای بعضی دیگر از مواد مایع مثل جیوه به علت بیشتر بودن نیروی چسبندگی بین ملکول های جیوه نسبت به نیروی بین جیوه و سطح ،جیوه جایی رو تر نمی کنه
به این خاطره که نیروی چسبندگی بین ملکول های آب از نیروی چسبندگی با اون سطحی که آب قرار داره کمتره.....به همین خاطر ملکول های آب از هم جدا شده و به سطح می چسبن که همون تر شدن هست...ولی برای بعضی دیگر از مواد مایع مثل جیوه به علت بیشتر بودن نیروی چسبندگی بین ملکول های جیوه نسبت به نیروی بین جیوه و سطح ،جیوه جایی رو تر نمی کنه
Re: چرا آب تره؟؟؟!!!!
خیلی ممنونjavad123javad نوشته شده:سلام
به این خاطره که نیروی چسبندگی بین ملکول های آب از نیروی چسبندگی با اون سطحی که آب قرار داره کمتره.....به همین خاطر ملکول های آب از هم جدا شده و به سطح می چسبن که همون تر شدن هست...ولی برای بعضی دیگر از مواد مایع مثل جیوه به علت بیشتر بودن نیروی چسبندگی بین ملکول های جیوه نسبت به نیروی بین جیوه و سطح ،جیوه جایی رو تر نمی کنه
فردا می رم می گم جوابو از استادای هوبا گرفتم
نه ..... این برف را دیگر سر بازایستادن نیست
برفی که بر ابرو و بر موی ما می نشیند.....
برفی که بر ابرو و بر موی ما می نشیند.....
Re: چرا آب تره؟؟؟!!!!
درود!javad123javad نوشته شده:به این خاطره که نیروی چسبندگی بین ملکول های آب از نیروی چسبندگی با اون سطحی که آب قرار داره کمتره.....به همین خاطر ملکول های آب از هم جدا شده و به سطح می چسبن که همون تر شدن هست...ولی برای بعضی دیگر از مواد مایع مثل جیوه به علت بیشتر بودن نیروی چسبندگی بین ملکول های جیوه نسبت به نیروی بین جیوه و سطح ،جیوه جایی رو تر نمی کنه
نیروی جاذبه ای که میان مولکول های یکسان وجود دارد،نیروی پیوستگی و نیروی جاذبه ای که میان مولکول های متفاوت وجود دارد،نیروی چسبندگی نامیده می شود!ودر خاصیت موئینگی هرگاه نیروی چسبندگی بر نیروی پیوستگی غالب باشد،مایع از لوله ی مویینه بالا می رود،مانند آب.آب به دیواره ی شیشه می چسبد و اصطلاحا آن را تر می کند و در آن بالا می رود.
موفق باشید!
- javad123javad
نام: Javad
محل اقامت: NoWhere
عضویت : پنجشنبه ۱۳۸۷/۳/۲ - ۱۱:۱۷
پست: 912-
سپاس: 211
- جنسیت:
Re: چرا آب تره؟؟؟!!!!
باسپاس از شما....Whisper نوشته شده:درود!javad123javad نوشته شده:به این خاطره که نیروی چسبندگی بین ملکول های آب از نیروی چسبندگی با اون سطحی که آب قرار داره کمتره.....به همین خاطر ملکول های آب از هم جدا شده و به سطح می چسبن که همون تر شدن هست...ولی برای بعضی دیگر از مواد مایع مثل جیوه به علت بیشتر بودن نیروی چسبندگی بین ملکول های جیوه نسبت به نیروی بین جیوه و سطح ،جیوه جایی رو تر نمی کنه
نیروی جاذبه ای که میان مولکول های یکسان وجود دارد،نیروی پیوستگی و نیروی جاذبه ای که میان مولکول های متفاوت وجود دارد،نیروی چسبندگی نامیده می شود!ودر خاصیت موئینگی هرگاه نیروی چسبندگی بر نیروی پیوستگی غالب باشد،مایع از لوله ی مویینه بالا می رود،مانند آب.آب به دیواره ی شیشه می چسبد و اصطلاحا آن را تر می کند و در آن بالا می رود.
موفق باشید!
تفاوت چندانی وجود ندارد.،تفاوت فقط در اسامی است.
بدرود
Re: چرا آب تره؟؟؟!!!!
جواد جان بنده جسارت نکردم بگم حرف شما غلطه!javad123javad نوشته شده:باسپاس از شما....
تفاوت چندانی وجود ندارد.،تفاوت فقط در اسامی است.
تنها خواستم کلی تر عرض کنم!
- javad123javad
نام: Javad
محل اقامت: NoWhere
عضویت : پنجشنبه ۱۳۸۷/۳/۲ - ۱۱:۱۷
پست: 912-
سپاس: 211
- جنسیت:
Re: چرا آب تره؟؟؟!!!!
سلام
بنده نیز چنین جسارتی نکردم.فقط برای این که ابهامی در دو توضیح پیش نیاد گفتم که فقط اسامی تفاوت دارن.....اتفاقاً توضیحاتتون بسیار کامل تر بود.....
ببخشید که منظورم رو بد رسوندم.....
با تشکر و بدرود
بنده نیز چنین جسارتی نکردم.فقط برای این که ابهامی در دو توضیح پیش نیاد گفتم که فقط اسامی تفاوت دارن.....اتفاقاً توضیحاتتون بسیار کامل تر بود.....
ببخشید که منظورم رو بد رسوندم.....
با تشکر و بدرود
Re: چرا آب تره؟؟؟!!!!
javad123javad نوشته شده:سلام
بنده نیز چنین جسارتی نکردم.فقط برای این که ابهامی در دو توضیح پیش نیاد گفتم که فقط اسامی تفاوت دارن.....اتفاقاً توضیحاتتون بسیار کامل تر بود.....
ببخشید که منظورم رو بد رسوندم.....
با تشکر و بدرود
 Re: چرا آب تره؟؟؟!!!!
Re: چرا آب تره؟؟؟!!!!
با برداشت از جواب ها به نظر من باید سوال رو این طور تغییر داد چرا آب تر میکنه ؟ در واقع برداشت من این بود که آب تر نیست آب تر میکنه.
هر انسانی یا مشهور است یا گمنام کننده ی یک مشهور
عظیم بودن یا یک عظمت را کشتن
جفای انسان به خود یعنی کشتن یک عظمت!!!
عظیم بودن یا یک عظمت را کشتن
جفای انسان به خود یعنی کشتن یک عظمت!!!
- sh.kamangir
عضویت : پنجشنبه ۱۳۸۷/۱۰/۱۲ - ۱۲:۵۳
پست: 10-
Re: چرا آب تره؟؟؟!!!!
واقعا که... شانس آوردین سرپرست تالار بود جوابتونو بده.. راحت میتونستین تصور کنین چرا جیوه تر نیست و تر نمیکنه؟ بعد تفاوتشو با آب پیدا میکردین و به جواب میرسیدین. باید یکم ذهنتونو باز کنین...
توازن سر انجام جهان ، و هر آنچه درون آن است
- rohamavation
نام: roham hesami radرهام حسامی راد
محل اقامت: 100 مایلی شمال لندن جاده آیلستون، لستر، لسترشر. LE2
عضویت : سهشنبه ۱۳۹۹/۸/۲۰ - ۰۸:۳۴
پست: 3282-
سپاس: 5494
- جنسیت:
تماس:
Re: چرا آب تره؟؟؟!!!!
ترشوندگی Wetability مولکولهای آب توسط پیوندهای هیدروژنی که شامل اتمهای هیدروژن و اتمهای اکسیژن است، به هم متصل میشوند. هنگامی که مولکول های آب با یک سطح تماس پیدا می کنند، این نیروها شرایط مرطوب بودن مایع را ایجاد می کنند.از نظر فیزیکی، ترشوندگی نشان دهنده تعادل نیروهایی است که در فصل مشترک بین سه فاز، که یکی از آنها جامد است، رخ می دهد. معادله ای که این تعادل را توصیف می کند برای یک سیستم نفت، آب و جامد، این معادله خواهد بود${\displaystyle \sigma _{\rm {os}}-\sigma _{\rm {ws}}+\sigma _{\rm {ow}}\cos \theta _{\rm {c}}=0}
$σos = انرژی سطحی بین روغن و جامد
σws = انرژی سطحی بین آب و جامد
σow = کشش سطحی بین روغن و آب
θC = زاویه تماس
ترشوندگی به سه روش تعیین می شود:
اندازه گیری زاویه تماس یا حاصل ضرب زاویه تماس و کشش سطحی (آخرین جمله در معادله یانگ)
اندازه گیری مقادیر نسبی نفت و آب جابجا شده در شرایط مشابه
مشاهدات جابجایی یا پدیده های سطحی مرتبط با فاز آب یا نفت
ترشوندگی توانایی یک مایع برای حفظ تماس با سطح جامد است و با تعادل بین برهمکنش های بین مولکولی نوع چسب (مایع به سطح) و نوع چسبنده (مایع به مایع) کنترل می شود.به تمایل مایع برای تماس با سطح جامدِ پوشانده شده با سیالی دیگر (گاز یا مایع)، ترشوندگی گفته میشود. گاهی نیاز به کاهش ترشوندگی سطح و گاهی نیاز با افزایش آن است.با دانستن کشش سطحی بحرانی یک جامد، می توان ترشوندگی سطح را پیش بینی کرد.ترشوندگی یک سطح توسط بیرونی ترین گروه های شیمیایی جامد تعیین می شود. تفاوت در ترشوندگی بین سطوحی که از نظر ساختار مشابه هستند به دلیل تفاوت در بسته بندی اتم ها است. به عنوان مثال، اگر سطحی دارای زنجیره های منشعب باشد، بسته بندی ضعیف تری نسبت به سطحی با زنجیره های مستقیم خواهد داشت. کشش سطح بحرانی کمتر به معنای سطح مواد کمتر خیسپذیر است. به عنوان مثال، سطح فلز را برای محافظت با ماده مخصوصی پوشش میدهند، در نتیجه ترشوندگی آن کاهش و آب بر روی سطح فلز پخش نخواهد شد. در مقابل، گاهی نیاز به افزایش ترشوندگی سطح جامد داریم.آب پس از ریختن بر روی هر سطحی، به طور کامل بر روی آن پخش میشود. در این صورت، برهمکنشهای جاذبه چسبندگی بین مولکولهای آب و مولکولهای سطح گسترش مییابند. بنابراین، نیروی چسبندگی دلیل خیس شدن سطح پس از ریختن مایعی بر روی آن است.سوال دیگری که ممکن است مطرح شود آن است که آیا نیروی سطحی تنها در سطح آب و مرز میان هوا و آب مشاهده میشود. پاسخ به این پرسش خیر است. کشش سطحی در مرز میان مایعات امتزاجناپذیر در یکدیگر نیز مشاهده میشود. کشش سطحی را با $$\gamma$$ نشان میدهیم. کشش سطحی میتواند خود را به شکل انرژی سطحی یا نیروی سطحی نشان دهد. برای افزایش سطح به اندازه $$dA$$ به انرژی و انجام کار نیاز داریم. کار مورد نیاز متناسب با تعداد مولکولهایی است که باید به سطح یا مرز مشترک مایع آورده شوند:
$$dW = \gamma dA$$در رابطه فوق، $$\gamma$$ مقدار انرژی لازم برای افزایش سطح به اندازه یک واحد است. کشش سطحی به سوالهای زیر پاسخ میدهد:
چرا قطرههای کوچک آب کروی هستند.ترشوندگی هنگامی مطرح میشود که چندین سطح با یکدیگر رقابت میکنند و هر سطح، سطح دیگر را به سمت خود میکشاند. در نتیجه این رقابت، زاویه تماسی بین فصل مشترکها به منظور بهینه کردن انرژی کشش سطحی کل، مشاهده میشود.ترشوندگی و زاویه تماس
گفتیم رفتار اتمها و مولکولها در حجم با رفتار آنها در سطح تفاوت دارد. به عنوان مثال ظرف نچسب مانند ماهیتابه را در نظر بگیرید. اگر قطرهای آب یا نفت در کف ماهیتابه بریزد، روی سطح پخش نخواهد شد.
ترشوندگی را می توان از طریق زاویه تماس اندازه گیری کردزاویه تماس معیاری برای ترشوندگی است. یک قطره مایع روی جامد قرار می گیرد و می توان زاویه تماس را به صورت نوری اندازه گیری کرد. CA_water به طور معمول، زاویه تماس 90 درجه به عنوان یک مقدار آستانه در نظر گرفته می شود. هنگامی که زاویه تماس بالای 90 درجه باشد ترشوندگی بد است، زمانی که زیر 90 درجه باشد ترشوندگی خوب است. خیس شدن کامل زمانی حاصل می شود که زاویه تماس صفر باشد، اگرچه در عمل زمانی که زوایای تماس کمتر از 5 درجه است، سطح به طور معمول کاملاً خیس شده در نظر گرفته می شود. هنگامی که از آب به عنوان مایع اندازه گیری استفاده می شود، زمانی که زاویه تماس بالای 90 درجه باشد، سطح آبگریز و زمانی که کمتر از همان مقدار باشد، آب دوست نامیده می شود.
قطرات روغن بر روی سطح ماهیتابه
در این حالت زاویه تماس بین مایع و سطح بیشتر از ۹۰ درجه است. در این حالت مایع کف ظرف را خیس نکرده است. زاویه تماس نشاندهنده آن است که آیا مایع بر روی سطح به خوبی پخش میشود یا خیر. اکنون حالت دیگری را در نظر بگیرید. فرض کنید قطرهای نفت یا آب در کاسه چینی میریزید. در این حالت، قطره کف کاسه چینی پخش میشود و زاویه تماس بسیار کوچکتر از ۹۰ درجه خواهد بود. در این حالت مایع کف کاسه را خیس میکند. زاویه تماس ویژگی بسیار مهمی است که برهمکنش بین مایع و سطح جامد را توصیف میکنند.سطح مشترک بین مایع و جامد
با توجه به کششهای سطحی و رابطه بین آنها، سه حالت اتفاق میافتد:
مثلث نویمان که انرژی های سطحی و زوایای تماس سه فاز سیال را که در تعادل استاتیکی همزیستی دارند، مرتبط می کند،
خط تماس را نشان می دهد که در آن سه فاز به هم می رسند. در حالت تعادل، نیروی خالص در واحد طول که در امتداد خط مرزی بین سه فاز عمل می کند باید صفر باشد. مولفه های نیروی خالص در جهت در امتداد هر یک از رابط ها به صورت زیر داده می شود:${\displaystyle {\begin{aligned}\gamma _{\alpha \theta }+\gamma _{\theta \beta }\cos \left(\theta \right)+\gamma _{\alpha \beta }\cos \left(\alpha \right)&=0\\\gamma _{\alpha \theta }\cos \left(\theta \right)+\gamma _{\theta \beta }+\gamma _{\alpha \beta }\cos \left(\beta \right)&=0\\\gamma _{\alpha \theta }\cos \left(\alpha \right)+\gamma _{\theta \beta }\cos \left(\beta \right)+\gamma _{\alpha \beta }&=0\end{aligned}}}$
زاویه تماس ۹۰ درجه: اگر کشش سطحی در مرز گاز-جامد و مایع-جامد با یکدیگر برابر باشند، زاویه تماس برابر ۹۰ درجه خواهد بود. در این حالت، سطح بین گاز-مایع کاهش مییابد.
زاوویه تماس ۹۰ درجه ترشوندگی بالا (زاویه تماس کمتر از ۹۰ درجه): اگر انرژی سطحی مرز گاز-جامد بیشتر از انرژی سطحی مرز مایع-جامد باشد، قطره روی زیرلایه پخش میشود. بنابراین، سطح زیرلایه جامد بیشتر از مایع پوشانده شده است. اگر مایع مورد نظر آب باشد، به زیرلایه جامد، زیرلایه آبدوست گفته میشود.
زاویه تماس کمتر ۹۰ درجه ترشوندگی کم (زاویه تماس بیشتر از ۹۰ درجه): اگر انرژی سطحی مرز جامد-مایع بیشتر از انرژی سطحی مرز گاز-جامد باشد، قطره به منظور کاهش سطح مشترک با زیرلایه، جمع میشود و به شکل کره درمیآید. بنابراین، سطح زیرلایه جامد بیشتر از گاز پوشانده شده است. اگر مایع مورد نظر آب باشد، به زیرلایه جامد، زیرلایه آبگریز میگوییم.
زاویه تماس بیشتر۹۰ درجه ترشوندگی بسیار بالا: اگر زاویه تماس برابر صفر باشد، میزان ترشوندگی زیرلایه بسیار بالا خواهد بود. در این حالت قطره به صورت لایهای بسیار نازک روی زیرلایه پخش میشود و بیشتر سطح آن را میپوشاند. این اتفاق هنگامی رخ میدهد که کشش سطحی گاز-جامد حتی از مجموع کششهای سطحی مرز مشترک جامد-مایع و گاز-مایع بیشتر باشد. اگر مایع مورد نظر آب باشد، به زیرلایه جامد، زیرلایه فوق آبدوست میگوییم.ترشوندگی بسیار کم: اگر زاویه تماس در حدود 180 باشد، میزان ترشوندگی زیرلایه بسیار کم خواهد بود. در این حالت قطره به صورت کره روی زیر لایه قرار میگیرد و بر روی آن پخش نمیشود. اگر مایع مورد نظر آب باشد، به زیرلایه جامد، زیرلایه فوق آبگریز میگوییم.
زاویه تماس و معادله یانگ
در مطالب بالا در مورد معادله یانگ صحبت کردیم. در این قسمت، این معادله را با جزییات بیشتری بررسی میکنیم. به تصویر زیر دقت کنید. قطرهای بر روی سطح جامد قرار گرفته و با گازی مانند هوا احاطه شده است.
$$\gamma_{\lg}$$ کشش سطحی در فصل مشترک بین مایع و گاز است.
$$\gamma_{sg}$$ کشش سطحی در فصل مشترک بین جامد و گاز است.
$$\gamma_{ls}$$ کشش سطحی در فصل مشترک بین مایع و جامد است.
قطره روی سطح حرکت نمیکند. بنابراین، بر طبق قانون دوم نیوتن، برایند نیروهای وارد بر آن برابر صفر است:
$$\gamma_{sg}= \gamma_{ls}+ \gamma_{\lg}\cos \theta$$
این معادله را بر حسب $$\cos \theta$$ مرتب میکنیم:
$$\cos \theta = \frac{\gamma_{sg} -\gamma_{ls}}{\gamma_{\lg}}$$
به معادله بالا، معادله یانگ میگوییم. در ادامه، هر یک از حالتهای ترشوندگی را با این معادله بررسی میکنیم:
زاویه تماس ۹۰ درجه: اگر زاویه تماس برابر ۹۰ درجه باشد، مقدار $$\cos \theta$$ برابر صفر خواهد بود. با توجه به رابطه یانگ، این حالت هنگامی اتفاق میافتد که کشش سطحی بین جامد-گاز برابر کشش سطحی فصل مشترک مایع-جامد باشد.ترشوندگی بالا (زاویه تماس کمتر از ۹۰ درجه): اگر زاویه تماس کمتر از ۹۰ درجه باشد، مقدار $$\cos \theta$$ بزرگتر از صفر و مثبت خواهد بود. بنابراین، انرژی سطحی مرز جامد-گاز از انرژی سطحی مرز مایع-جامد بیشتر است.ترشوندگی کم (زاویه تماس بیشتر از ۹۰ درجه): اگر زاویه تماس بیشتر از ۹۰ درجه باشد، مقدار $$\cos \theta$$ کمتر از صفر و منفی خواهد بود. بنابراین، انرژی سطحی مرز مایع-جامد از انرژی سطحی مرز گاز-جامد بیشتر است.تاکنون با تعریف ترشوندگی، انواع و رابطه آن با کشش سطحی آشنا شدیم. در ادامه، در مورد سطح آبدوست و آبگریز صحبت میکنیم.
سطوح آب دوست و آب گریز
سطح آبگریز، همانطور که از نامش مشخص است، آب را از خود دور میکند. انرژی سطحیِ سطح آبگریز کم است. اگر قطره آبی بر روی این سطح قرار بگیرد، زاویه تماس آن از ۹۰ درجه بیشتر خواهد بود. اگر زاویه تماس از ۱۵۰ درجه بیشتر شود، سطح فوق آبگریز نامیده میشود. قطره آب از روی این سطح میپرد یا لیز میخورد.نظریه سطوح فوق آب گریز
در مطالب فوق، در مورد معادله یانگ و رابطه زاویه تماس با کششها سطحی بین سطوح مختلف صحبت کردیم. علاوه بر مدل یانگ، مدلهای دیگری نیز برای توصیف ترشوندگی سطوح وجود دارند. به عنوان مثال، مدل «ونزل» (Wenzel)، زاویه تماس سطح زبر را با استفاده از رابطه زیر مشخص میکند:
$$\cos \theta_w= r (\frac{\gamma_{sg}-\gamma _ {sl}}{\gamma_{\lg}}) = r \cos \theta$$
در رابطه فوق:
$$\theta_w$$ زاویه تماس روی سطح با زبری $$r$$ است.
$$r$$ میزان زبری سطح است. اگر مقدار $$r$$ برابر یک باشد، سطح کاملا مسطح است. در صورتی که مقدار $$r$$ از یک بزرگتر باشد، سطح دارای پستی و بلندی و به اصطلاح زبر است.
معادله ونزل تنها برای سطح مشترک همگن مایع-جامد، معتبر است. برای سطوح مشترک ناهمگن، مدل «کسی-بکستر» (Cassie-Baxter) استفاده میشود:
$$\cos \theta_{cb} = f (1 + \cos \theta_ w) -1 $$
در این معادله:
$$\theta_{cb}$$ زاویه تماس روی سطح با زبری $$r$$ است.
$$f$$ نسبتی از سطح در نظر گرفته میشود که با قطره در تماس است و بین صفر و یک قرار دارد. اگر مقدار آن برابر صفر باشد، مایع سطح را لمس نکرده است. همچنین، اگر $$f =1$$ باشد، سطح به طور کامل با مایع پوشانده شده است. این حالت برای سطحی رخ میدهد که به طور کامل مسطح باشد.
سه مدل تعیین زاویه تماس
زاویه تماس قطره آب با سطح به حجم قطره آب و نیروی اینرسی وارد شده از طرف جاذبه بستگی دارد. این زاویه با استفاده از مدلهای برازش مختلف مانند بیضی، دایره، مماسی و لاپلاس-یانگ اندازه گرفته میشود.
برای یک قطره بدون نشست، انرژی آزاد سیستم سه فاز را می توان به صورت زیر بیان کرد${\displaystyle \delta w=\gamma _{LV}dA_{LV}+\gamma _{SL}dA_{SL}+\gamma _{SV}dA_{SV}-\kappa dL-PdV-VdP}$در حجم ثابت در تعادل ترمودینامیکی، این کاهش می یابد: ${\displaystyle 0={\frac {dA_{LG}}{dA_{SL}}}+{\frac {\gamma _{SL}-\gamma _{SG}}{\gamma _{LG}}}-{\frac {\kappa }{\gamma _{LG}}}{\frac {dL}{dA_{SL}}}-{\frac {V}{\gamma _{LG}}}{\frac {dP}{dA_{SL}}}}$معمولاً اصطلاح VdP برای قطرات بزرگ نادیده گرفته می شود، با این حال، کار VdP در مقیاس های کوچک قابل توجه می شود. تغییر فشار در حجم ثابت در مرز مایع و بخار آزاد ناشی از فشار لاپلاس است که متناسب با میانگین انحنای قطره است و غیر صفر است. حل معادله بالا برای هر دو سطح محدب و مقعر نتیجه می دهد:
کشش سطحی نیرویی است که در واحد طول به طور معمول بر یک خط عمل می کند. بخش کوچکی از محیط قطره را که من به عنوان ℓ علامت گذاری کرده ام در نظر بگیرید
. ما ℓ را فرض می کنیم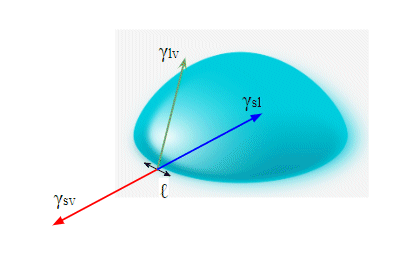
به اندازه کافی کوچک است که بتوان آن را مستقیم در نظر گرفت. اگر کشش سطحی بخار $\gamma_{sv}$ باشد
سپس این نیرو روی خط ℓ ما تولید می کند
$F = \gamma_{sv} \ell$ همانطور که توسط خط قرمز نشان داده شده است. بنابراین مجموع نیروی بیرونی عبارت است از:
$F_\text{out} = \gamma_{sv} \ell$
به همین ترتیب در داخل قطره کشش سطحی بین جامد و مایع قطره را با نیروی$F = \gamma_{ls} \ell$ به سمت داخل می کشد.
. این با خط آبی نشان داده می شود.
و در نهایت کشش سطحی در فصل مشترک مایع و بخار عنصر خط ما را با نیروی$F = \gamma_{ls} \ell$ می کشد.
و با زاویه θ به سمت بالا میکشد
جایی که θ
زاویه تماس است. بنابراین مولفه افقی این نیرو خط ما را با نیروی $F = \gamma_{lv} \ell \cos\theta$ به سمت داخل می کشد.
. این با خط سبز نشان داده می شود. بنابراین مجموع نیروهای به سمت داخل (فلش های آبی و سبز) عبارتند از:
$F_\text{in} = \gamma_{sl} \ell + \gamma_{lv} \ell \cos\theta$
و آخرین مرحله فقط این است که بگوییم اگر قطره در حالت تعادل است، یعنی نه در حال پخش شدن است و نه غلتیدن، پس نیروهای درونی و بیرونی باید یکسان باشند:
$\gamma_{sv} \ell = \gamma_{sl} \ell + \gamma_{lv} \ell \cos\theta$و فقط بر ℓ تقسیم کنید برای بدست آوردن معادله یانگ:
$\gamma_{sv} = \gamma_{sl} + \gamma_{lv} \cos\theta$
نظریه سطوح فوق آب گریز
در مورد معادله یانگ و رابطه زاویه تماس با کششها سطحی بین سطوح مختلف علاوه بر مدل یانگ، مدلهای دیگری نیز برای توصیف ترشوندگی سطوح وجود دارند. به عنوان مثال، مدل «ونزل» (Wenzel)، زاویه تماس سطح زبر را با استفاده از رابطه زیر مشخص میکند:
$$\cos \theta_w= r (\frac{\gamma_{sg}-\gamma _ {sl}}{\gamma_{\lg}}) = r \cos \theta$$
در رابطه فوق:
$$\theta_w$$ زاویه تماس روی سطح با زبری $$r$$ است.
$$r$$ میزان زبری سطح است. اگر مقدار $$r$$ برابر یک باشد، سطح کاملا مسطح است. در صورتی که مقدار $$r$$ از یک بزرگتر باشد، سطح دارای پستی و بلندی و به اصطلاح زبر است.
معادله ونزل تنها برای سطح مشترک همگن مایع-جامد، معتبر است. برای سطوح مشترک ناهمگن، مدل «کسی-بکستر» (Cassie-Baxter) استفاده میشود:
$$\cos \theta_{cb} = f (1 + \cos \theta_ w) -1 $$
در این معادله:
$$\theta_{cb}$$ زاویه تماس روی سطح با زبری $$r$$ است.
$$f$$ نسبتی از سطح در نظر گرفته میشود که با قطره در تماس است و بین صفر و یک قرار دارد. اگر مقدار آن برابر صفر باشد، مایع سطح را لمس نکرده است. همچنین، اگر $$f =1$$ باشد، سطح به طور کامل با مایع پوشانده شده است. این حالت برای سطحی رخ میدهد که به طور کامل مسطح باشد.نظریه سطوح فوق آب گریز
$σos = انرژی سطحی بین روغن و جامد
σws = انرژی سطحی بین آب و جامد
σow = کشش سطحی بین روغن و آب
θC = زاویه تماس
ترشوندگی به سه روش تعیین می شود:
اندازه گیری زاویه تماس یا حاصل ضرب زاویه تماس و کشش سطحی (آخرین جمله در معادله یانگ)
اندازه گیری مقادیر نسبی نفت و آب جابجا شده در شرایط مشابه
مشاهدات جابجایی یا پدیده های سطحی مرتبط با فاز آب یا نفت
ترشوندگی توانایی یک مایع برای حفظ تماس با سطح جامد است و با تعادل بین برهمکنش های بین مولکولی نوع چسب (مایع به سطح) و نوع چسبنده (مایع به مایع) کنترل می شود.به تمایل مایع برای تماس با سطح جامدِ پوشانده شده با سیالی دیگر (گاز یا مایع)، ترشوندگی گفته میشود. گاهی نیاز به کاهش ترشوندگی سطح و گاهی نیاز با افزایش آن است.با دانستن کشش سطحی بحرانی یک جامد، می توان ترشوندگی سطح را پیش بینی کرد.ترشوندگی یک سطح توسط بیرونی ترین گروه های شیمیایی جامد تعیین می شود. تفاوت در ترشوندگی بین سطوحی که از نظر ساختار مشابه هستند به دلیل تفاوت در بسته بندی اتم ها است. به عنوان مثال، اگر سطحی دارای زنجیره های منشعب باشد، بسته بندی ضعیف تری نسبت به سطحی با زنجیره های مستقیم خواهد داشت. کشش سطح بحرانی کمتر به معنای سطح مواد کمتر خیسپذیر است. به عنوان مثال، سطح فلز را برای محافظت با ماده مخصوصی پوشش میدهند، در نتیجه ترشوندگی آن کاهش و آب بر روی سطح فلز پخش نخواهد شد. در مقابل، گاهی نیاز به افزایش ترشوندگی سطح جامد داریم.آب پس از ریختن بر روی هر سطحی، به طور کامل بر روی آن پخش میشود. در این صورت، برهمکنشهای جاذبه چسبندگی بین مولکولهای آب و مولکولهای سطح گسترش مییابند. بنابراین، نیروی چسبندگی دلیل خیس شدن سطح پس از ریختن مایعی بر روی آن است.سوال دیگری که ممکن است مطرح شود آن است که آیا نیروی سطحی تنها در سطح آب و مرز میان هوا و آب مشاهده میشود. پاسخ به این پرسش خیر است. کشش سطحی در مرز میان مایعات امتزاجناپذیر در یکدیگر نیز مشاهده میشود. کشش سطحی را با $$\gamma$$ نشان میدهیم. کشش سطحی میتواند خود را به شکل انرژی سطحی یا نیروی سطحی نشان دهد. برای افزایش سطح به اندازه $$dA$$ به انرژی و انجام کار نیاز داریم. کار مورد نیاز متناسب با تعداد مولکولهایی است که باید به سطح یا مرز مشترک مایع آورده شوند:
$$dW = \gamma dA$$در رابطه فوق، $$\gamma$$ مقدار انرژی لازم برای افزایش سطح به اندازه یک واحد است. کشش سطحی به سوالهای زیر پاسخ میدهد:
چرا قطرههای کوچک آب کروی هستند.ترشوندگی هنگامی مطرح میشود که چندین سطح با یکدیگر رقابت میکنند و هر سطح، سطح دیگر را به سمت خود میکشاند. در نتیجه این رقابت، زاویه تماسی بین فصل مشترکها به منظور بهینه کردن انرژی کشش سطحی کل، مشاهده میشود.ترشوندگی و زاویه تماس
گفتیم رفتار اتمها و مولکولها در حجم با رفتار آنها در سطح تفاوت دارد. به عنوان مثال ظرف نچسب مانند ماهیتابه را در نظر بگیرید. اگر قطرهای آب یا نفت در کف ماهیتابه بریزد، روی سطح پخش نخواهد شد.
ترشوندگی را می توان از طریق زاویه تماس اندازه گیری کردزاویه تماس معیاری برای ترشوندگی است. یک قطره مایع روی جامد قرار می گیرد و می توان زاویه تماس را به صورت نوری اندازه گیری کرد. CA_water به طور معمول، زاویه تماس 90 درجه به عنوان یک مقدار آستانه در نظر گرفته می شود. هنگامی که زاویه تماس بالای 90 درجه باشد ترشوندگی بد است، زمانی که زیر 90 درجه باشد ترشوندگی خوب است. خیس شدن کامل زمانی حاصل می شود که زاویه تماس صفر باشد، اگرچه در عمل زمانی که زوایای تماس کمتر از 5 درجه است، سطح به طور معمول کاملاً خیس شده در نظر گرفته می شود. هنگامی که از آب به عنوان مایع اندازه گیری استفاده می شود، زمانی که زاویه تماس بالای 90 درجه باشد، سطح آبگریز و زمانی که کمتر از همان مقدار باشد، آب دوست نامیده می شود.
قطرات روغن بر روی سطح ماهیتابه
در این حالت زاویه تماس بین مایع و سطح بیشتر از ۹۰ درجه است. در این حالت مایع کف ظرف را خیس نکرده است. زاویه تماس نشاندهنده آن است که آیا مایع بر روی سطح به خوبی پخش میشود یا خیر. اکنون حالت دیگری را در نظر بگیرید. فرض کنید قطرهای نفت یا آب در کاسه چینی میریزید. در این حالت، قطره کف کاسه چینی پخش میشود و زاویه تماس بسیار کوچکتر از ۹۰ درجه خواهد بود. در این حالت مایع کف کاسه را خیس میکند. زاویه تماس ویژگی بسیار مهمی است که برهمکنش بین مایع و سطح جامد را توصیف میکنند.سطح مشترک بین مایع و جامد
با توجه به کششهای سطحی و رابطه بین آنها، سه حالت اتفاق میافتد:
مثلث نویمان که انرژی های سطحی و زوایای تماس سه فاز سیال را که در تعادل استاتیکی همزیستی دارند، مرتبط می کند،
خط تماس را نشان می دهد که در آن سه فاز به هم می رسند. در حالت تعادل، نیروی خالص در واحد طول که در امتداد خط مرزی بین سه فاز عمل می کند باید صفر باشد. مولفه های نیروی خالص در جهت در امتداد هر یک از رابط ها به صورت زیر داده می شود:${\displaystyle {\begin{aligned}\gamma _{\alpha \theta }+\gamma _{\theta \beta }\cos \left(\theta \right)+\gamma _{\alpha \beta }\cos \left(\alpha \right)&=0\\\gamma _{\alpha \theta }\cos \left(\theta \right)+\gamma _{\theta \beta }+\gamma _{\alpha \beta }\cos \left(\beta \right)&=0\\\gamma _{\alpha \theta }\cos \left(\alpha \right)+\gamma _{\theta \beta }\cos \left(\beta \right)+\gamma _{\alpha \beta }&=0\end{aligned}}}$
زاویه تماس ۹۰ درجه: اگر کشش سطحی در مرز گاز-جامد و مایع-جامد با یکدیگر برابر باشند، زاویه تماس برابر ۹۰ درجه خواهد بود. در این حالت، سطح بین گاز-مایع کاهش مییابد.
زاوویه تماس ۹۰ درجه ترشوندگی بالا (زاویه تماس کمتر از ۹۰ درجه): اگر انرژی سطحی مرز گاز-جامد بیشتر از انرژی سطحی مرز مایع-جامد باشد، قطره روی زیرلایه پخش میشود. بنابراین، سطح زیرلایه جامد بیشتر از مایع پوشانده شده است. اگر مایع مورد نظر آب باشد، به زیرلایه جامد، زیرلایه آبدوست گفته میشود.
زاویه تماس کمتر ۹۰ درجه ترشوندگی کم (زاویه تماس بیشتر از ۹۰ درجه): اگر انرژی سطحی مرز جامد-مایع بیشتر از انرژی سطحی مرز گاز-جامد باشد، قطره به منظور کاهش سطح مشترک با زیرلایه، جمع میشود و به شکل کره درمیآید. بنابراین، سطح زیرلایه جامد بیشتر از گاز پوشانده شده است. اگر مایع مورد نظر آب باشد، به زیرلایه جامد، زیرلایه آبگریز میگوییم.
زاویه تماس بیشتر۹۰ درجه ترشوندگی بسیار بالا: اگر زاویه تماس برابر صفر باشد، میزان ترشوندگی زیرلایه بسیار بالا خواهد بود. در این حالت قطره به صورت لایهای بسیار نازک روی زیرلایه پخش میشود و بیشتر سطح آن را میپوشاند. این اتفاق هنگامی رخ میدهد که کشش سطحی گاز-جامد حتی از مجموع کششهای سطحی مرز مشترک جامد-مایع و گاز-مایع بیشتر باشد. اگر مایع مورد نظر آب باشد، به زیرلایه جامد، زیرلایه فوق آبدوست میگوییم.ترشوندگی بسیار کم: اگر زاویه تماس در حدود 180 باشد، میزان ترشوندگی زیرلایه بسیار کم خواهد بود. در این حالت قطره به صورت کره روی زیر لایه قرار میگیرد و بر روی آن پخش نمیشود. اگر مایع مورد نظر آب باشد، به زیرلایه جامد، زیرلایه فوق آبگریز میگوییم.
زاویه تماس و معادله یانگ
در مطالب بالا در مورد معادله یانگ صحبت کردیم. در این قسمت، این معادله را با جزییات بیشتری بررسی میکنیم. به تصویر زیر دقت کنید. قطرهای بر روی سطح جامد قرار گرفته و با گازی مانند هوا احاطه شده است.
$$\gamma_{\lg}$$ کشش سطحی در فصل مشترک بین مایع و گاز است.
$$\gamma_{sg}$$ کشش سطحی در فصل مشترک بین جامد و گاز است.
$$\gamma_{ls}$$ کشش سطحی در فصل مشترک بین مایع و جامد است.
قطره روی سطح حرکت نمیکند. بنابراین، بر طبق قانون دوم نیوتن، برایند نیروهای وارد بر آن برابر صفر است:
$$\gamma_{sg}= \gamma_{ls}+ \gamma_{\lg}\cos \theta$$
این معادله را بر حسب $$\cos \theta$$ مرتب میکنیم:
$$\cos \theta = \frac{\gamma_{sg} -\gamma_{ls}}{\gamma_{\lg}}$$
به معادله بالا، معادله یانگ میگوییم. در ادامه، هر یک از حالتهای ترشوندگی را با این معادله بررسی میکنیم:
زاویه تماس ۹۰ درجه: اگر زاویه تماس برابر ۹۰ درجه باشد، مقدار $$\cos \theta$$ برابر صفر خواهد بود. با توجه به رابطه یانگ، این حالت هنگامی اتفاق میافتد که کشش سطحی بین جامد-گاز برابر کشش سطحی فصل مشترک مایع-جامد باشد.ترشوندگی بالا (زاویه تماس کمتر از ۹۰ درجه): اگر زاویه تماس کمتر از ۹۰ درجه باشد، مقدار $$\cos \theta$$ بزرگتر از صفر و مثبت خواهد بود. بنابراین، انرژی سطحی مرز جامد-گاز از انرژی سطحی مرز مایع-جامد بیشتر است.ترشوندگی کم (زاویه تماس بیشتر از ۹۰ درجه): اگر زاویه تماس بیشتر از ۹۰ درجه باشد، مقدار $$\cos \theta$$ کمتر از صفر و منفی خواهد بود. بنابراین، انرژی سطحی مرز مایع-جامد از انرژی سطحی مرز گاز-جامد بیشتر است.تاکنون با تعریف ترشوندگی، انواع و رابطه آن با کشش سطحی آشنا شدیم. در ادامه، در مورد سطح آبدوست و آبگریز صحبت میکنیم.
سطوح آب دوست و آب گریز
سطح آبگریز، همانطور که از نامش مشخص است، آب را از خود دور میکند. انرژی سطحیِ سطح آبگریز کم است. اگر قطره آبی بر روی این سطح قرار بگیرد، زاویه تماس آن از ۹۰ درجه بیشتر خواهد بود. اگر زاویه تماس از ۱۵۰ درجه بیشتر شود، سطح فوق آبگریز نامیده میشود. قطره آب از روی این سطح میپرد یا لیز میخورد.نظریه سطوح فوق آب گریز
در مطالب فوق، در مورد معادله یانگ و رابطه زاویه تماس با کششها سطحی بین سطوح مختلف صحبت کردیم. علاوه بر مدل یانگ، مدلهای دیگری نیز برای توصیف ترشوندگی سطوح وجود دارند. به عنوان مثال، مدل «ونزل» (Wenzel)، زاویه تماس سطح زبر را با استفاده از رابطه زیر مشخص میکند:
$$\cos \theta_w= r (\frac{\gamma_{sg}-\gamma _ {sl}}{\gamma_{\lg}}) = r \cos \theta$$
در رابطه فوق:
$$\theta_w$$ زاویه تماس روی سطح با زبری $$r$$ است.
$$r$$ میزان زبری سطح است. اگر مقدار $$r$$ برابر یک باشد، سطح کاملا مسطح است. در صورتی که مقدار $$r$$ از یک بزرگتر باشد، سطح دارای پستی و بلندی و به اصطلاح زبر است.
معادله ونزل تنها برای سطح مشترک همگن مایع-جامد، معتبر است. برای سطوح مشترک ناهمگن، مدل «کسی-بکستر» (Cassie-Baxter) استفاده میشود:
$$\cos \theta_{cb} = f (1 + \cos \theta_ w) -1 $$
در این معادله:
$$\theta_{cb}$$ زاویه تماس روی سطح با زبری $$r$$ است.
$$f$$ نسبتی از سطح در نظر گرفته میشود که با قطره در تماس است و بین صفر و یک قرار دارد. اگر مقدار آن برابر صفر باشد، مایع سطح را لمس نکرده است. همچنین، اگر $$f =1$$ باشد، سطح به طور کامل با مایع پوشانده شده است. این حالت برای سطحی رخ میدهد که به طور کامل مسطح باشد.
سه مدل تعیین زاویه تماس
زاویه تماس قطره آب با سطح به حجم قطره آب و نیروی اینرسی وارد شده از طرف جاذبه بستگی دارد. این زاویه با استفاده از مدلهای برازش مختلف مانند بیضی، دایره، مماسی و لاپلاس-یانگ اندازه گرفته میشود.
برای یک قطره بدون نشست، انرژی آزاد سیستم سه فاز را می توان به صورت زیر بیان کرد${\displaystyle \delta w=\gamma _{LV}dA_{LV}+\gamma _{SL}dA_{SL}+\gamma _{SV}dA_{SV}-\kappa dL-PdV-VdP}$در حجم ثابت در تعادل ترمودینامیکی، این کاهش می یابد: ${\displaystyle 0={\frac {dA_{LG}}{dA_{SL}}}+{\frac {\gamma _{SL}-\gamma _{SG}}{\gamma _{LG}}}-{\frac {\kappa }{\gamma _{LG}}}{\frac {dL}{dA_{SL}}}-{\frac {V}{\gamma _{LG}}}{\frac {dP}{dA_{SL}}}}$معمولاً اصطلاح VdP برای قطرات بزرگ نادیده گرفته می شود، با این حال، کار VdP در مقیاس های کوچک قابل توجه می شود. تغییر فشار در حجم ثابت در مرز مایع و بخار آزاد ناشی از فشار لاپلاس است که متناسب با میانگین انحنای قطره است و غیر صفر است. حل معادله بالا برای هر دو سطح محدب و مقعر نتیجه می دهد:
کشش سطحی نیرویی است که در واحد طول به طور معمول بر یک خط عمل می کند. بخش کوچکی از محیط قطره را که من به عنوان ℓ علامت گذاری کرده ام در نظر بگیرید
. ما ℓ را فرض می کنیم

به اندازه کافی کوچک است که بتوان آن را مستقیم در نظر گرفت. اگر کشش سطحی بخار $\gamma_{sv}$ باشد
سپس این نیرو روی خط ℓ ما تولید می کند
$F = \gamma_{sv} \ell$ همانطور که توسط خط قرمز نشان داده شده است. بنابراین مجموع نیروی بیرونی عبارت است از:
$F_\text{out} = \gamma_{sv} \ell$
به همین ترتیب در داخل قطره کشش سطحی بین جامد و مایع قطره را با نیروی$F = \gamma_{ls} \ell$ به سمت داخل می کشد.
. این با خط آبی نشان داده می شود.
و در نهایت کشش سطحی در فصل مشترک مایع و بخار عنصر خط ما را با نیروی$F = \gamma_{ls} \ell$ می کشد.
و با زاویه θ به سمت بالا میکشد
جایی که θ
زاویه تماس است. بنابراین مولفه افقی این نیرو خط ما را با نیروی $F = \gamma_{lv} \ell \cos\theta$ به سمت داخل می کشد.
. این با خط سبز نشان داده می شود. بنابراین مجموع نیروهای به سمت داخل (فلش های آبی و سبز) عبارتند از:
$F_\text{in} = \gamma_{sl} \ell + \gamma_{lv} \ell \cos\theta$
و آخرین مرحله فقط این است که بگوییم اگر قطره در حالت تعادل است، یعنی نه در حال پخش شدن است و نه غلتیدن، پس نیروهای درونی و بیرونی باید یکسان باشند:
$\gamma_{sv} \ell = \gamma_{sl} \ell + \gamma_{lv} \ell \cos\theta$و فقط بر ℓ تقسیم کنید برای بدست آوردن معادله یانگ:
$\gamma_{sv} = \gamma_{sl} + \gamma_{lv} \cos\theta$
نظریه سطوح فوق آب گریز
در مورد معادله یانگ و رابطه زاویه تماس با کششها سطحی بین سطوح مختلف علاوه بر مدل یانگ، مدلهای دیگری نیز برای توصیف ترشوندگی سطوح وجود دارند. به عنوان مثال، مدل «ونزل» (Wenzel)، زاویه تماس سطح زبر را با استفاده از رابطه زیر مشخص میکند:
$$\cos \theta_w= r (\frac{\gamma_{sg}-\gamma _ {sl}}{\gamma_{\lg}}) = r \cos \theta$$
در رابطه فوق:
$$\theta_w$$ زاویه تماس روی سطح با زبری $$r$$ است.
$$r$$ میزان زبری سطح است. اگر مقدار $$r$$ برابر یک باشد، سطح کاملا مسطح است. در صورتی که مقدار $$r$$ از یک بزرگتر باشد، سطح دارای پستی و بلندی و به اصطلاح زبر است.
معادله ونزل تنها برای سطح مشترک همگن مایع-جامد، معتبر است. برای سطوح مشترک ناهمگن، مدل «کسی-بکستر» (Cassie-Baxter) استفاده میشود:
$$\cos \theta_{cb} = f (1 + \cos \theta_ w) -1 $$
در این معادله:
$$\theta_{cb}$$ زاویه تماس روی سطح با زبری $$r$$ است.
$$f$$ نسبتی از سطح در نظر گرفته میشود که با قطره در تماس است و بین صفر و یک قرار دارد. اگر مقدار آن برابر صفر باشد، مایع سطح را لمس نکرده است. همچنین، اگر $$f =1$$ باشد، سطح به طور کامل با مایع پوشانده شده است. این حالت برای سطحی رخ میدهد که به طور کامل مسطح باشد.نظریه سطوح فوق آب گریز




