ببین قانون اول ترمودینامیک فرمول بندی قانون بقای انرژی در زمینه فرآیندهای ترمودینامیکیه که در آن دو شکل اصلی انتقال انرژی و گرما و کار ترمودینامیکی متمایز میشن که سیستم ترمودینامیکی مقدار ثابتی از ماده را تغییر میده. قانون همچنین انرژی درونی یک سیستم را تعریف میکنه با نظر گرفتن تعادل این انرژی ها در سیستم. انرژی را نه نمیتونی ایجاد یا از بین ببری اما میتونه از شکلی به شکل دیگر تبدیل بشه. در یک سیستم ایزوله مجموع تمام اشکال انرژی ثابته.عزیز دلم W=0 کار خارجی روی سیستم شما توسط . کار الکتریکی انجام شده $$W=\int I(t)\ V(t) \ dt$$ است اونم توسط نیروی خارجی گرانش
برای ترکیب وزنه و ترمال هیتر شما کار خارجی توسط گرانش روی وزن (توسط زمین) انجام میشه. تقریباً مقدار مساوی گرما ازترمال هیتر به آب منتقل میشه فکر کنم کمی گیج کننده هستش ولی قشنگ از خود شکل معلومه و جواب میده اون اوایل مثل شما فکر میکردم مخصوصاتو درس ترموی خودم با مشکل مواجه میشدم اما با نگاه به سیستم زود متوجه میشدم زیرا با گرم شدن آب ترمال هیتر کمی گرمتر میشه. اما این افزایش انرژی داخلی النت شما در مقایسه با افزایش انرژی داخلی آب ناچیزه. همه حالت های میانی حالت های تعادل ترمودینامیکی نیستن و نمیتونی از قانون اول ترمودینامیک برای تعیین انرژی داخلی این حالت ها استفاده کنی. فقط میتونی برای حالت نهایی که دوباره در تعادل ترمودینامیکی هستش استفاده کنی فهمیدی دوست من بازم بهت بگم به نظر من میتونیم قانون اول ترمودینامیک را به اینطور بگم
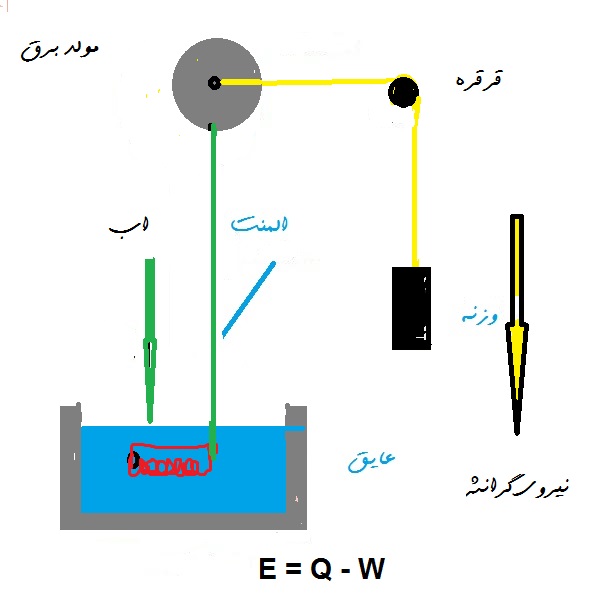
در هر فرآیند ترمودینامیکی بین حالتهای تعادل i و f مقدار Q + W برای هر مسیر بین i و f یکسانه. برابره با تغییر مقدار یک تابع حالت به نام انرژی داخلی$ E_int$ ببین قانون اول ترمودینامیک یک نتیجه کامل کلیه که برای هر فرآیندی در طبیعت که بین حالتهای تعادل پیش میره اعمال میشه. لازم نیستش که هر مرحله از فرآیند یک حالت تعادل باشه فقط حالت اولیه و نهایی باشه.قانون اول ترمو رو اعمال کن ببین درمورد سیستم اگاهی داشته باش شکل شما یک کویل گرمایش غوطه ور در آب موجود در یک ظرف را نشون میده. جریان عبوری از ترمال هیتر توسط یک ژنراتور (ایده آل) تامین میشه درسته خوب معلومه که که توسط وزنه ای که با سرعت ثابت سقوط میکنه هدایت میشه ببین که چه مقادیری از Qو W و $AE_int$ برای انتخابهای دلخواه متفاوتی که سیستم خود را انتخاب میکنی نتیجه میده
اول سیستم = آب به تنهایی. گرما از ترمال هیتر به آب میرسه به طوری که Q>0. هیچ کاری انجام نمیشه چون زیرا آب تحت تأثیر نیروی خارجی که به آن واردمیشه شود حرکت نمیکنه پس W = 0. از قانون اول ترمو
AE > 0. گرمای وارد شده به آب باعث افزایش انرژی داخلی و در نتیجه دمای اب میشه درسته خوب دوم ببین. ترمال هیتر سیستم + وزن. تا زمانی که وزن با سرعت ثابتی کاهش می یاببه ترمال هیتر شما دمای ثابتی را حفظ میکنه بنابراین سیستم شمادر یک حالت ثابته و هیچ انتقال انرژی در مرز سیستم انجام نمیشه خوب دیگه AEnt=0. انرژی گرمایی از ترمال هیتر به آب از این سیستم منتقل میشه به طوری که Q<0.
کار توسط نیروی گرانشی (خارجی) انجام می شود به طوری که W> 0. سیستم به عنوان مجرای انرژی عمل میکنه کار انجام شده توسط نیروی گرانشی به عنوان انرژی گرمایی به آب منتقل میشه
فکر کنم فهمیدی